Un White Paper di Medicines for Europe fa il punto sui costi e strategie a supporto del riposizionamento di medicinali già noti nella pratica clinica
Il “repurposing” come fil rouge delle strategie per affrontare tempestivamente i bisogni sanitari insoddisfatti, rispondendo anche agli obiettivi delineati dalla Pharma Strategy europea e al Piano europeo contro il cancro. A ricordare che c’è ancora un significativo potenziale non sfruttato di riutilizzo dei medicinali, sintetizzando le strategie necessarie a sostenerne la diffusione, il White Paper diffuso oggi da Medicines for Europe dal titolo Advancing medicines repurposing in the EU.
Sotto la lente la necessità di arrivare alla registrazione delle nuove indicazioni.
«Portare nuove indicazioni in etichetta è fondamentale per il successo di qualsiasi un strategia di riutilizzo», sottolinea il documento, elencando i diversi e numerosi problemi a associati all’uso off-label di medicinali:
• Mancanza di valutazione ufficiale delle prove scientifiche (quando un medicinale viene utilizzato off-label i dati di Real World Evidence non sono disponibili);
• Mancanza di sistemi di raccolta dati (l’assenza dell’indicazione in etichetta non agevola il monitoraggio della sicurezza ed efficacia realizzata tramite i registri dei pazienti o l farmacovigilanza)
• Problemi di responsabilità (con conseguente maggior resistenza da parte dei prescrittori);
• Problemi di rimborso (i pagatori generalmente non sono disposti a rimborsare i medicinali per le indicazioni non ufficialmente convalidate dalle autorità di regolamentazione);
• Problemi di approvvigionamento (l’uso off-label di un medicinale non è quantificato: può derivarne scarsa accuratezza nella previsione dei volumi necessari e rischio di interruzione della fornitura dovuta a sottovalutazione della domanda);
• Preoccupazioni dei pazienti (che potrebbero non sentirsi a proprio agio utilizzando un medicinale per una indicazione che non è stata esplicitamente approvata dalle autorità di regolamentazione).
Percorso a due vie a supporto delle aziende
«I titolari delle autorizzazioni all’immissione in commercio sono spesso coinvolti nelle prime fasi de percorso di repurposing, ma gli sforzi di ricerca possono essere guidati e sostenuti anche da altre parti interessate, come le organizzazioni no profit e organizzazioni accademiche», sottolinea il paper, illustrando i due i possibili approcci in materia:
a) Il progetto pilota STAMP e il ruolo dei “supporter”
Il progetto pilota STAMP lanciato dall’EMA e dai responsabili delle Agenzie regolatorie europee punta a sostenere organizzazioni no profit e accademie nella generazione di evidenze scientifiche a favore dell’uso di medicinali esistenti per nuove indicazioni fino ad ottenerne formale autorizzazione da parte delle autorità di regolamentazione. Una volta raccolti i dati per avviare il progetto il supporter potrà contattare direttamente il titolare dell’AIC e il processo sarà facilitato dall’EMA o dall’Autorità nazionale competente attraverso l’accesso all’articolo 57 del database EMA. Offrendo sostegno ai supporter nello sforzo di generazione e analisi dei dati STAMP faciliterà lo sviluppo di evidenze da sottoporre alle valutazioni regolamentari, colmando il divario tra ricerca e applicazione traslazionale della stessa.
b) L’ottimizzazione attraverso i consorzi
Il coinvolgimento dell’industria nelle prime fasi del il processo di repurposing non è incompatibile con l’impegno di accademico, dei paziente e delle organizzazioni senza scopo di lucro. Il raggruppamento di risorse e competenze sotto forma di consorzio può facilitare i partenariati tra le parti interessate e favorire lo scambio di informazioni sui medicinali riproporre. Il coinvolgimento precoce dell'industria, sia come unico motore dello sforzo di generazione dei dati o come parte di un consorzio, permette comunque di progettare al meglio il farmaco per lo scopo previsto.
I costi del repurposing
«Il progetto STAMP ha il potenziale giusto per promuovere significativamente la ricerca sul riutilizzo di farmaci consolidati, ma da solo non sarà sufficiente per realizzare il pieno potenziale di repurposing presente nell’UE - prosegue l’analisi di Medicines for Europe -. Sarebbe necessario integrarlo in parallelo con iniziative a sostegno dell’industria, perché la generazione e la convalida dei dati di ricerca e il completamento dell’iter regolamentare non sono sufficienti per la messa a disposizione del medicinale per i pazienti dell’UE».
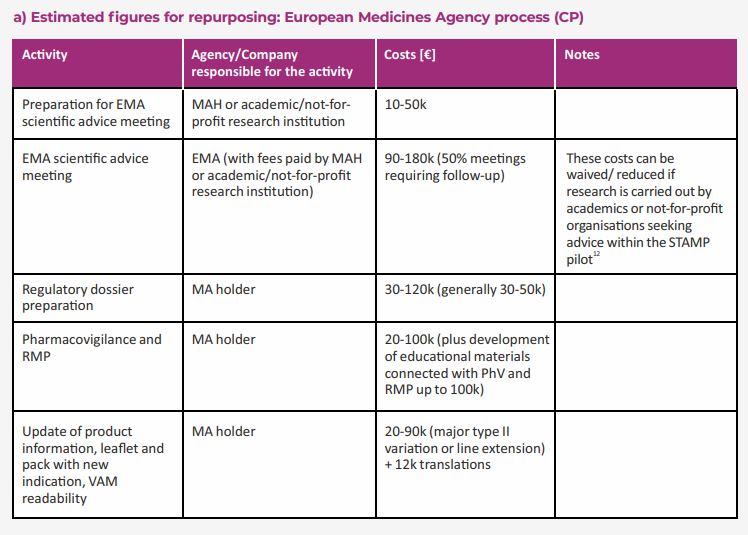
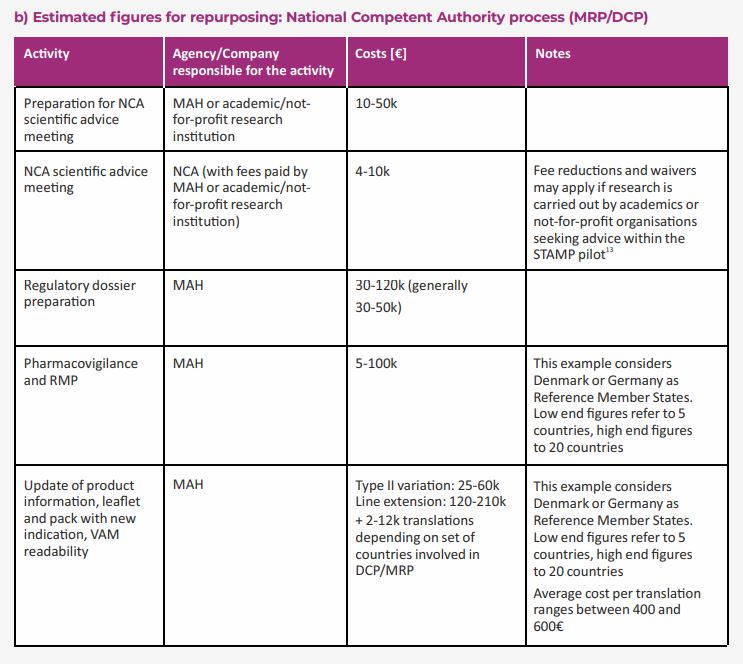
Ottenuta l’approvazione normativa, i titolari dell’AIC investono infatti ulteriori risorse per la pianificazione della produzione, i costi di commercializzazione, la richiesta di valutazioni per l’accesso al mercato. La stima dei costi legati ai processi post-normativi nelle tabelle contenute nel documento:
«Anche alla lue di questi investimenti - conclude il paper - serve un approccio su misura per lo sviluppo dei Medicinali a valore aggiunto (VAM), che dovrebbero essere riconosciuti come un gruppo autonomo nella legislazione dell’UE - conclude il paper -. Il riconoscimento legislativo dei VAM dovrebbe portare alla creazione di a percorso normativo dedicato e alla possibilità di premiare adeguatamente gli investimenti e le risorse dedicate a sviluppare medicinali basati su principi attivi noti, introducendo una regolamentazione che preveda incentivi e procedure di rimborso adeguate».
_________________
Foto: Anna Tis su Pexels